Necesidad de métodos rápidos de detección de endotoxinas para los fabricantes de radiofármacos
Los radiofármacos son agentes radiactivos que se utilizan con fines diagnósticos o terapéuticos. Estos agentes se introducen en el cuerpo humano con una finalidad específica, como aumentar el contraste[1]. Debido a la inyección directa de estos productos químicos en el cuerpo humano, se hace imperativo monitorearlos para detectar cualquier signo de contaminación por pirógenos.
La endotoxina bacteriana es un pirógeno muy potente que induce fiebre. Las bacterias gramnegativas (GNB) son el único origen de la misma, y la endotoxina representa aproximadamente el 75% de la pared celular de las bacterias gramnegativas. La contaminación bacteriana en el agua y en las superficies suele incluir GNB, lo que da lugar a la ubicuidad de la endotoxina.[2]
Prueba de pirógenos
El propósito de realizar pruebas de pirógenos es mantener un nivel seguro y aceptable de riesgo de fiebre causado por una inyección farmacéutica. Aunque es posible fabricar equipos y recipientes de almacenamiento de fármacos libres de pirógenos, eliminar completamente los pirógenos de los preparados farmacéuticos resulta ser un reto insuperable, ya que estos productos químicos contienen intrínsecamente trazas de pirógenos. A niveles bajos de trazas provenientes de estas fuentes, que normalmente miden menos de 0,2 unidades de endotoxina/mL de inyectado, no tienen el potencial de inducir una respuesta febril en los pacientes[3].
Para cumplir con la normativa de la FDA, cualquier producto farmacéutico destinado a uso parenteral en humanos, sea radiactivo o no, debe someterse a una certificación que garantice su esterilidad y la ausencia de pirógenos. Estas certificaciones deben seguir los procedimientos de Prueba de Endotoxina Bacteriana (BET) especificados en la Farmacopea de los Estados Unidos (USP <85>)[3].
Relevancia del ensayo LAL en radiofármacos
La USP <85> incluye una descripción específica del ensayo LAL para el análisis de endotoxinas en el contexto de los radiofármacos. La prueba LAL se realiza haciendo reaccionar la sangre del Limulus, una especie de cangrejo herradura, con endotoxina bacteriana, lo que da lugar a la formación de un coágulo de gel. Los kits de ensayo LAL disponibles actualmente incluyen los métodos turbidimétrico, cromogénico y de coágulo de gel de este ensayo.
La prueba LAL (lisado de amebocitos de Limulus) ha demostrado ser cinco veces más sensible que la prueba del conejo para la detección de pirógenos. Gracias a su mayor sensibilidad, la prueba LAL es especialmente recomendable para analizar fármacos que se van a administrar por vía intratecal. Esto se debe a que la endotoxina introducida directamente en el líquido cefalorraquídeo es, al menos, 1.000 veces más potente que si se administra por vía intravenosa.[3]
La USP <85> establece específicamente los límites de endotoxinas para los radiofármacos en 14 EU (unidades de endotoxinas) por dosis si se administran por vía intratecal o 175 EU por dosis si se administran por cualquier otra vía.[4] Los radiofármacos suponen un reto único para las pruebas de endotoxinas, ya que sus ingredientes tienen una vida útil extremadamente corta. La guía <825> de la USP sobre radiofármacos destaca la necesidad de realizar pruebas rápidas de estos productos. En concreto, las normas exigen que la prueba BET se realice antes de la administración si no se ha certificado previamente que todos los ingredientes están libres de endotoxinas.[5] Esta limitación de tiempo no permite que la técnica de coágulo de gel obtenga resultados en 60 minutos. Por lo tanto, las técnicas de detección rápida de endotoxinas son imprescindibles para el éxito de las pruebas de radiofármacos.
Modificaciones del ensayo LAL para radiofármacos
Debido a la presencia de agentes quelantes en los radiofármacos marcados con 99mTc, existe una probabilidad significativa de obtener resultados falsos negativos. Estos agentes reducen la concentración de iones de calcio divalentes libres en el reactivo de LAL, lo que provoca la inhibición de la formación de gel de coagulina y puede causar un resultado falso negativo.
La adición de una solución de cloruro cálcico puede emplearse como medio para afrontar la inhibición observada en un ensayo de LAL empleado para radiofármacos marcados con 99mTc y sus kits fríos que poseen SH libre, COOH libre o ambos de estos grupos.
Los hospitales y las radiofarmacias centrales confían ahora en esta adaptación modificada del método de ensayo LAL para realizar pruebas de control de calidad de sus radiofármacos y kits fríos.[6]
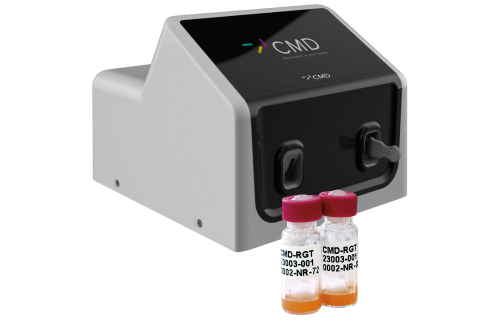
Para que las pruebas sean rápidas sin comprometer la precisión, se han implementado nuevos desarrollos. El sistema CMD αBET™ es un avance tecnológico de reciente desarrollo que cumple con las regulaciones de la FDA. Es una opción fácil de usar y portátil para las pruebas de pirógenos, que ofrece una alternativa más rápida a los métodos tradicionales. El sistema utiliza el reactivo LAL de alta eficiencia para las pruebas y tiene tiempos de ejecución variables en función de la concentración de la muestra, que van desde tres minutos para una muestra de 10 EU/mL hasta 30 minutos para muestras con 0,001 EU/mL.
Fuentes bibliográficas
- Munjal, A. and N. Gupta, Radiopharmaceuticals, in StatPearls. 2024, StatPearls Publishing Copyright © 2024, StatPearls Publishing LLC.: Treasure Island (FL) ineligible companies. Disclosure: Nishant Gupta declares no relevant financial relationships with ineligible companies.
- Cooper, J.F. and J.C.J.U.o.N.M. Hung, Health Sciences Center, College of Pharmacy, Bacterial endotoxin test and sterility test for radiopharmaceuticals. 2008. 14(5): p. 30-35.
- Karesh, S.M.J.J.o.n.m.t., Sterility and pyrogen testing of radiopharmaceuticals. 1989. 17(3): p. 156-159.
- <85> Bacterial endotoxin test, United States Pharmacopia.
- <825> Radiopharmaceuticals-preparation, compounding, dispensing, and repackaging, United States Pharmacopia.
- Mitra, A., et al., Limulus amebocyte lysate testing: adapting it for determination of bacterial endotoxin in 99mTc-labeled radiopharmaceuticals at a hospital radiopharmacy. J Nucl Med Technol, 2014. 42(4): p. 278-82.